Smart Living und Innovationen
07.11.2011
Wie eine Zelle die Welt revolutioniert
Die Batterie – eine revolutionäre Erfindung
Der italienische Physiker Alessandro Giuseppe Antonio Anastasio Graf von Volta (*1745; † 1827) erfindet die Batterie und gilt damit als einer der Begründer des Zeitalters der Elektrizität. Zu seinen Ehren wurde die Maßeinheit für die elektrische Spannung „Volt“ genannt.
Seiner Konstruktion ist eine Entdeckung des Anatomieprofessors Luigi Galvani (1737 – 1798) vorausgegangen . Galvani hatte Froschschenkel durch die Berührung mit Metallen zum Zucken gebracht und daraus eine „tierische Elektrizität“ geschlossen. Volta hat dies jedoch nicht ganz geglaubt und nach einer Reihe von Experimenten die Volta-Säule konstruiert.
Das Volta-Element – die galvanische Zelle
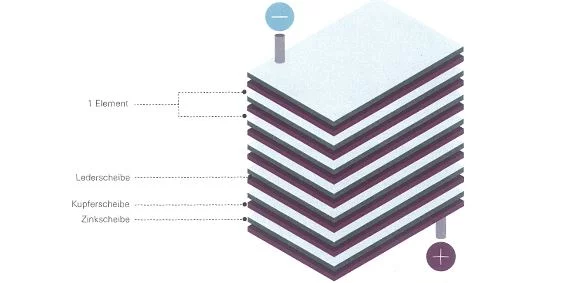
Dieser Prototyp der Batterie war die erste nutzbare Stromquelle und zählt zu den bedeutendsten Erfindungen aller Zeiten. Sie besteht aus vielen übereinander geschichteten Kupfer- und Zinkplättchen, zwischen denen sich elektrolytgetränkte Karton- oder Lederstücke befinden.
Die kleinste Einheit der Volta-Säule wird Volta-Element oder auch Galvanische Zelle genannt und ist die Grundform der Batterie. Sie besteht aus einer Kupferfolie, einem Elektrolyten und einer Zinkfolie.
Um höhere Spannungen zu erzielen, werden mehrere Volta-Elemente miteinander verbunden und in Reihe geschalten – so addieren sich die Spannungen der einzelnen Elemente zu einer Gesamtspannung.
Wie funktioniert dieses Wunderding „Batterie“?
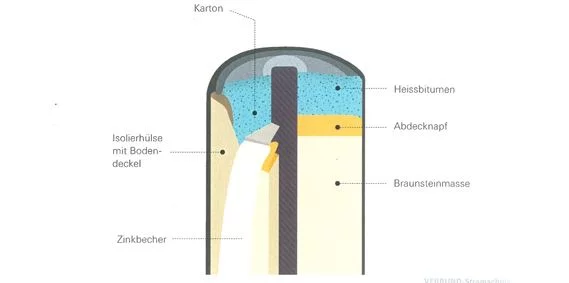
Die Zink-Kohle Batterie besteht aus einem Zink-Becher, in dessen Mitte sich ein Kohlestift befindet. Zwischen dem Zinkbecher und dem Kohlestift befindet sich Braunstein (Manganoxid) und ein mit einer elektrolytischen Lösung (Salmiak oder Ammoniumchlorid) getränkter Karton. Der Zinkbecher stellt den Minuspol, der Kohlestift den Pluspol der Batterie dar.
In Kontakt mit der elektrolytischen Lösung oxidiert das Zink und die Zinkatome geben Elektronen frei. Diese fließen über den Verbraucher (z. B. eine Glühbirne) zum Pluspol der Batterie. Dort werden sie durch Mangan-Ionen des Braunsteins aufgenommen. Wenn der Zinkbecher keine Elektronen mehr abgeben bzw. der Braunstein keine mehr aufnehmen kann, ist die Batterie entladen.
Zum Nachmachen: Batterie selber herstellen
„Bastler“ können dieses Prinzip der Batterie auch selbst nachstellen. Einfach eine Zinkplatte und eine Kupferplatte in eine halbe Zitrone stecken; die Platten dürfen sich dabei jedoch nicht berühren, damit es nicht zu einem Kurzschluss kommt. Diese beiden Platten sind die Pole der Zitronenbatterie. Mit Krokodilklemmen werden dann Kabel und eine Leuchtdiode an die Pole angeschlossen. Schon ist der Stromkreis fertig und die Zitronenbatterie bringt die Leuchtdiode zum Leuchten.
Dieses Experiment funktioniert auch mit rohen Kartoffeln, Orangen oder Äpfeln – welche aber, wie auch die Zitrone, nach dem Experiment nicht mehr zum Verzehr geeignet sind.
Der italienische Physiker Alessandro Giuseppe Antonio Anastasio Graf von Volta (*1745; † 1827) erfindet die Batterie und gilt damit als einer der Begründer des Zeitalters der Elektrizität. Zu seinen Ehren wurde die Maßeinheit für die elektrische Spannung „Volt“ genannt.
Seiner Konstruktion ist eine Entdeckung des Anatomieprofessors Luigi Galvani (1737 – 1798) vorausgegangen . Galvani hatte Froschschenkel durch die Berührung mit Metallen zum Zucken gebracht und daraus eine „tierische Elektrizität“ geschlossen. Volta hat dies jedoch nicht ganz geglaubt und nach einer Reihe von Experimenten die Volta-Säule konstruiert.
Das Volta-Element – die galvanische Zelle
Dieser Prototyp der Batterie war die erste nutzbare Stromquelle und zählt zu den bedeutendsten Erfindungen aller Zeiten. Sie besteht aus vielen übereinander geschichteten Kupfer- und Zinkplättchen, zwischen denen sich elektrolytgetränkte Karton- oder Lederstücke befinden.
Die kleinste Einheit der Volta-Säule wird Volta-Element oder auch Galvanische Zelle genannt und ist die Grundform der Batterie. Sie besteht aus einer Kupferfolie, einem Elektrolyten und einer Zinkfolie.
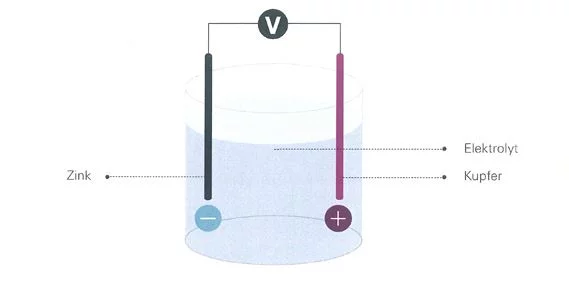
Das Volta-Element wurde weiterentwickelt und anstatt der Folien tauchen eine Kupferplatte und eine Zinkplatte in verdünnte Schwefelsäure. Durch chemische Reaktionen wird die Kupferplatte zum positiven Pol und die Zinkplatte zum negativen Pol. Verbindet man die beiden Platten, findet der Ladungsausgleich statt: Elektronen wandern vom negativen zum positiven Pol.
Um höhere Spannungen zu erzielen, werden mehrere Volta-Elemente miteinander verbunden und in Reihe geschalten – so addieren sich die Spannungen der einzelnen Elemente zu einer Gesamtspannung.
Wie funktioniert dieses Wunderding „Batterie“?
Die Zink-Kohle Batterie besteht aus einem Zink-Becher, in dessen Mitte sich ein Kohlestift befindet. Zwischen dem Zinkbecher und dem Kohlestift befindet sich Braunstein (Manganoxid) und ein mit einer elektrolytischen Lösung (Salmiak oder Ammoniumchlorid) getränkter Karton. Der Zinkbecher stellt den Minuspol, der Kohlestift den Pluspol der Batterie dar.
In Kontakt mit der elektrolytischen Lösung oxidiert das Zink und die Zinkatome geben Elektronen frei. Diese fließen über den Verbraucher (z. B. eine Glühbirne) zum Pluspol der Batterie. Dort werden sie durch Mangan-Ionen des Braunsteins aufgenommen. Wenn der Zinkbecher keine Elektronen mehr abgeben bzw. der Braunstein keine mehr aufnehmen kann, ist die Batterie entladen.

Zum Nachmachen: Batterie selber herstellen
„Bastler“ können dieses Prinzip der Batterie auch selbst nachstellen. Einfach eine Zinkplatte und eine Kupferplatte in eine halbe Zitrone stecken; die Platten dürfen sich dabei jedoch nicht berühren, damit es nicht zu einem Kurzschluss kommt. Diese beiden Platten sind die Pole der Zitronenbatterie. Mit Krokodilklemmen werden dann Kabel und eine Leuchtdiode an die Pole angeschlossen. Schon ist der Stromkreis fertig und die Zitronenbatterie bringt die Leuchtdiode zum Leuchten.
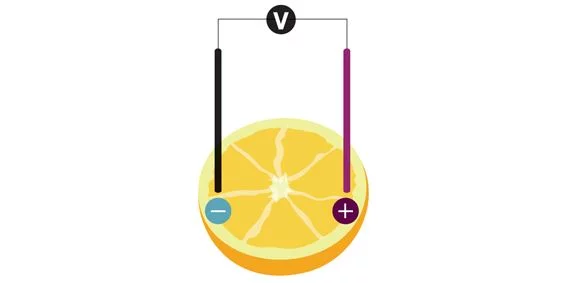
Ist bei der Zitronen-Batterie der Stromkreis geschlossen, findet eine chemische Reaktion zwischen den beiden Metallen und dem Saft der Zitrone statt, bei der Elektronen von der Zinkplatte zur Kupferplatte wandern. Elektronenfluss ist ja nichts anderes als elektrischer Strom, der die Leuchtdioden zum Leuchten bringt. Der Zitronensaft leitet elektrischen Strom, deshalb wird er als Elektrolyt bezeichnet.
Dieses Experiment funktioniert auch mit rohen Kartoffeln, Orangen oder Äpfeln – welche aber, wie auch die Zitrone, nach dem Experiment nicht mehr zum Verzehr geeignet sind.